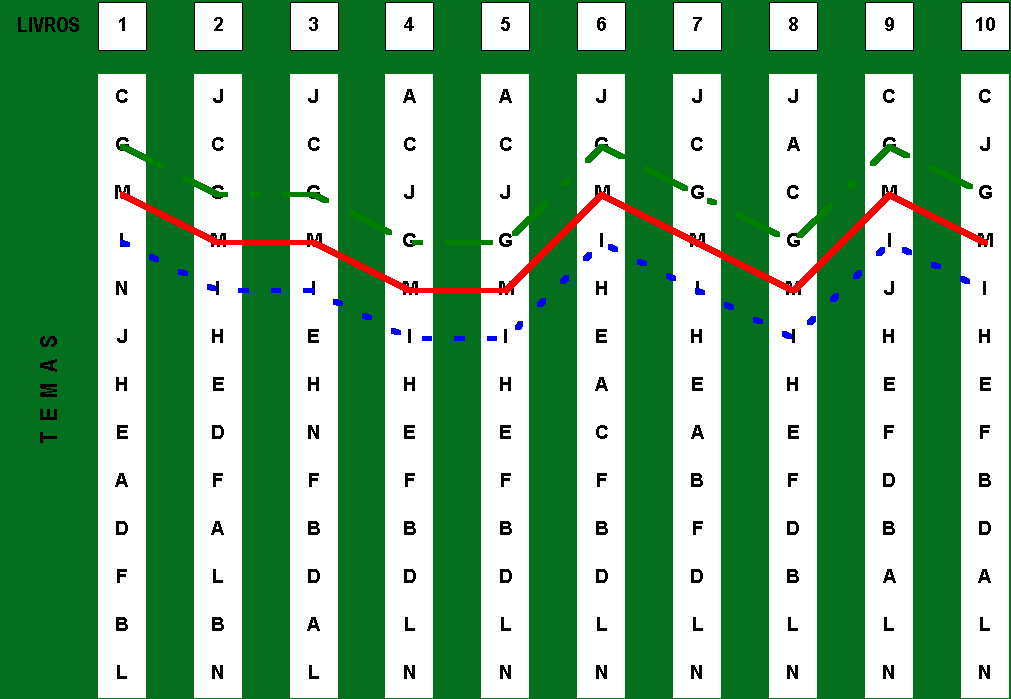
Figura 1: “Matriz de Precedências” indicando o relacionamento
entre os temas: Estrutura Atômica (G), Periodicidade Química
(M) e Ligação Química (I)
Waldmir Nascimento de Araujo Neto
Centro Federal de Educação Tecnológica de Química
de Nilópolis
Universidade Federal Fluminense
Joana Mara Teixeira Santos
Universidade do Estado do Rio de Janeiro
Resumo
O presente trabalho examina a forma como a noção clássica de valência é apropriada pelo currículo do ensino médio de Química, através da análise de dez livros didáticos, de acordo com treze temas. Observa-se que as relações históricas de precedência são em geral negligenciadas. O modelo utilizado parece preconizar a solução de problemas matemáticos ao invés de estimular o entendimento conceitual. No entanto, foram identificadas, através das definições apresentadas pelos autores, as mesmas categorias ontológicas que foram historicamente constituídas para este conceito.
Abstract
The study develop a framework for examining the way
in which chemistry textbooks describe valence and in this perspective indicates
a manner of how the high school chemistry curricula incorporates this notion.
Ten textbooks were evaluated according to thirteen themes. Results obtained
showed that most textbooks lacked a history precedence and did not deal
with the conceptual understanding. Nevertheless it appears that the same
historical ontological categories can be find in the textbooks.
1 - Introdução
Várias iniciativas e esforços, revelados pelo crescente número de publicações e investigações a respeito do ensino de Química, procuram dar forma e conteúdo ao desejo de resgate de significado da prática pedagógica desta disciplina. A educação científica precisa estar alerta para que seus aprendizes não creiam nas verdades científicas nem fiquem somente pasmados diante de tantos resultados espetaculares. Aristóteles dizia que é no espanto que começa toda a ciência. Espinoza, por sua vez, declarava que certo tipo de espanto e fascínio constitui um "estado embrutecido" negador de inteligência e gerador de submissão.
Um dos contravenenos para o dogmatismo no ensino de ciências consiste em ensiná-las em sua história. Muitos cientistas buscaram verificar a validade de seus instrumentos de análise, confrontando-os com a história anterior de sua ciência. O retorno ao passado constituiu uma espécie de estratégia para melhor se interpretar e transformar o presente. Segundo Hilton Japiassú (1999) um dos grandes méritos de um ensino "histórico das ciências" consiste em permitir aos alunos a apreensão de uma totalidade que lhes escapa, além da satisfação de seu desejo de conhecimento, ao serem comunicados sobre um saber científico em seu passado. Um estudo do passado revela que a Química é carregada de ambigüidades e conflitos de idéias, em desacordo com o modelo monolítico em direção a onisciência.
Uma tendência de aproximação histórica já procura, de uma forma ou de outra, se manifestar nos livros didáticos de Química. O livro didático pode ser entendido como agente cultural que: está conectado ao currículo organizado pela escola; seleciona conteúdos considerados relevantes e apropriados à série escolar para qual foi elaborado; desenvolve conteúdos, tendo em vista sua apropriação pelo aprendiz; possui forma de apresentação conforme seqüência considerada adequada e própria para utilização.
As atividades educacionais realizadas nas instituições escolares, são, em boa medida, condicionadas pela utilização dos livros didáticos. O saber a ser ensinado passa por uma segmentação, seleção e organização em seqüências progressivas; sofre um processo, conforme considerado por Magda Soares (1996), de didatização ou escolarização. Os currículos, programas e materiais didáticos representariam assim estratégias sociais e educacionais para a concretização e operacionalização desse saber escolarizado. Os livros didáticos são um dos instrumentos escolares utilizados para assegurar a aquisição dos saberes e competências julgados indispensáveis à inserção das novas gerações na sociedade, ou seja, saberes que a ninguém seria permitido ignorar.
Ainda segundo a perspectiva apresentada por Magda Soares, assumida como sócio-histórica, os livros didáticos convertem-se em uma fonte privilegiada para a constituição de uma história do ensino e das disciplinas escolares. Permitem identificar e recuperar os saberes e as competências considerados formadores em determinado momento, a política cultural e social imposta em determinada época, qual o processo de escolarização do conhecimento, da ciência e das práticas culturais. Um olhar sobre o livro didático pode conduzir a uma história do ensino, das práticas escolares, da transformação das disciplinas.
Segundo Jurjo Santomé (1998), os livros didáticos eram marcados por duas características principais: primeira, como recurso estrito e editado para uso exclusivo dos alunos; segundo, o local de sua utilização era exclusivamente a escola. Apesar de ainda mantidas, a essas duas características, segundo Santomé, deve ser acrescentada uma terceira: destinado também aos professores. São eles que primeiramente tem acesso e decidem qual deve ser adquirido. O texto concebido deve ajudá-los a concretizar a missão de escolarização durante o período de tempo de trabalho.
O livro didático oferece ao professor uma seleção de temas que pretende ser vendida como, conforme citado por Santomé, "um trabalho a menos que este deve realizar" (p. 156). Um material eficiente deve estar em conformidade com o programa oficial instituído pelo Estado. As informações dos livros texto podem determinar as questões fundamentais de cada disciplina. Cooperam para delimitar o que os alunos têm de saber em cada curso, o ritmo das aprendizagens, bem como a progressão dos conteúdos em cada matéria. Nas mais diversas especialidades do conhecimento são estabelecidas pesquisas que apontam críticas e exigências sobre o currículo que deve estar contemplado nos livros didáticos. Como orientador ou organizador das atividades escolares, o livro didático per si ainda carrega uma formulação conteudista, articulada com uma visão disciplinar do conhecimento.
Assumindo a perspectiva conteudista como algo dado
à regra de elaboração do livro didático, e
tendo-se que este objeto constitui uma extensa influência como critério
de seleção e organização do currículo
em diferentes segmentos do ensino, pretende-se, no presente trabalho, elaborar
uma leitura a respeito da forma que diferentes autores do ensino médio
de Química utilizam ou apropriam um conteúdo; especificamente
sobre a noção clássica de valência. Pretende-se
verificar em que medida se deu um possível distanciamento do conceito
de valência em relação aos livros didáticos
de química do ensino médio, tendo-se como referência
às edições mais atuais, e utilizando-se como viés
metodológico a formalização de relações
históricas de precedência desse conceito sobre outros componentes
curriculares da Química. Pretende-se utilizar como referência
a linha teórica de autores que sustentam a aproximação
do ensino das ciências com a história das ciências.
2 – Metodologia
Foram consultados dez livros didáticos de química para o ensino médio com edições nos últimos nove anos.
Tabela 1: Livros didáticos de Química consultados (VU = Volume Único; CO = Coleção)
|
|
|
|
|
|
|
|
Geraldo Camargo de Carvalho |
|
|
|
|
|
Juan Ferre |
|
|
|
|
|
Utimura & Linguanoto |
|
|
|
|
|
Vera Novais |
|
|
|
|
|
Usberco & Salvador |
|
|
|
|
|
Hartwig, Souza e Mota |
|
|
|
|
|
Ricardo Feltre |
|
|
|
|
|
Tito & Canto |
|
|
|
|
|
Martha Reis Marques da Fonseca |
|
|
|
|
|
Antônio Sardella |
|
|
|
Não foram utilizados critérios estatísticos para a escolha dos livros. Foram utilizados autores segundo a facilidade de obtenção da obra. Todos os livros são indicados para utilização no ensino médio, tanto os de volume único quanto os de coleção. Os temas considerados são em alguns livros itens e em outros subitens. Foram escolhidos somente aqueles que apareciam em todas as obras analisadas.
Os temas selecionados para estudo são aqueles que se referem ao primeiro ano do Ensino Médio ¾ Química Geral. Diferentes autores identificam um mesmo conteúdo a ser trabalhado em seus livros de forma diversa. Alguns temas que ocorrem como título de capítulo em um e como subitem em outro. Optou-se por uma normalização na identificação dos conteúdos a serem analisados, sendo estes referenciados por treze temas. A descrição do tema não necessariamente guarda identidade com o que é observado na obra, mas se refere ao mesmo conteúdo[1]. A mesma normalização foi realizada no que se refere à quantidade de temas. Novamente, cada autor possui em sua obra uma distribuição diversa em termos da quantidade de temas. Mesmo quando em uma obra o tema escolhido não ocorria como título do capítulo ou tema central, foi considerada sua seqüência relativa aos outros temas ou capítulos. Os conteúdos dos livros analisados foram classificados em treze temas.
|
|
|
|
|
Leis ponderais |
|
|
Estudo dos gases |
|
|
Átomo de Dalton |
|
|
Fórmulas químicas |
|
|
Reações químicas |
|
|
Mol, quantidade de matéria e número de Avogadro |
|
|
Estrutura atômica |
|
|
Funções da Química inorgânica |
|
|
Ligações Químicas |
|
|
Aspectos macroscópicos |
|
|
Estequiometria |
|
|
Periodicidade Química |
|
|
Radioatividade |
A padronização na identificação
e na quantidade dos temas possibilitou a construção de uma
"matriz de precedências". Essa matriz cumpriu o papel de ferramental,
a fim de auxiliar na identificação de possíveis regularidades
na distribuição dos temas.
3 – Resultados e discussão
A análise que se seguirá pretende verificar as possibilidades da metodologia indicada nesse trabalho no sentido de revelar regularidades, discrepâncias, distâncias e aproximações que possam ocorrer na organização do conhecimento químico em livros do ensino médio adotando perspectiva(s) didática(s) e perspectiva(s) histórica(s). Para tanto, seleciona-se um grupo de temas, que são localizados e tabelados, a partir dos livros analisados, em função de sua seqüenciação.
Dedica-se em seguida a verificação
de como a noção clássica de valência ocorre
e quais autores fazem uso dela. Será considerada uma ocorrência
cada vez que um autor fizer referência a essa noção,
explicitamente em forma de definição, assertiva, enunciado,
descrição, em qualquer parte da obra, mesmo que fora dos
capítulos destinados aos temas em observação.
3.1 - Conteúdos e suas precedências

Figura 1: “Matriz de Precedências” indicando o relacionamento
entre os temas: Estrutura Atômica (G), Periodicidade Química
(M) e Ligação Química (I)
Os aspectos relacionados à distribuição eletrônica segundo o diagrama de Linus Pauling estabelecem um vínculo forte com o capítulo de Periodicidade Química. Todos os autores analisados focalizam com muita atenção argumentos, demonstrações, tabelas e recursos gráficos para que o aluno seja capaz de estabelecer a relação entre a posição do elemento químico na tabela e sua distribuição eletrônica. Essa relação se torna "crucial" na medida em que descortina as regularidades que elementos dos chamados grupos representativos ¾ grupos 1, 2 e de 13 a 18 na classificação periódica ¾ possuem em relação à quantidade de elétrons no último nível de energia. A leitura da quantidade de elétrons no último nível de energia é requerida para o contexto de justificação e demonstração a respeito das Ligações Químicas.
Ressalta-se nesse momento outra regularidade. A noção de eletronegatividade é apresentada, por todos os autores, sem exceção, no interior do tema de Periodicidade Química.
A matriz referente a figura 2 recorta dois temas que possuem, historicamente, relações de precedência bem marcadas. No entanto observa-se que, didaticamente, existe um grande espalhamento entre as precedências dos temas Leis ponderais e Periodicidade química.
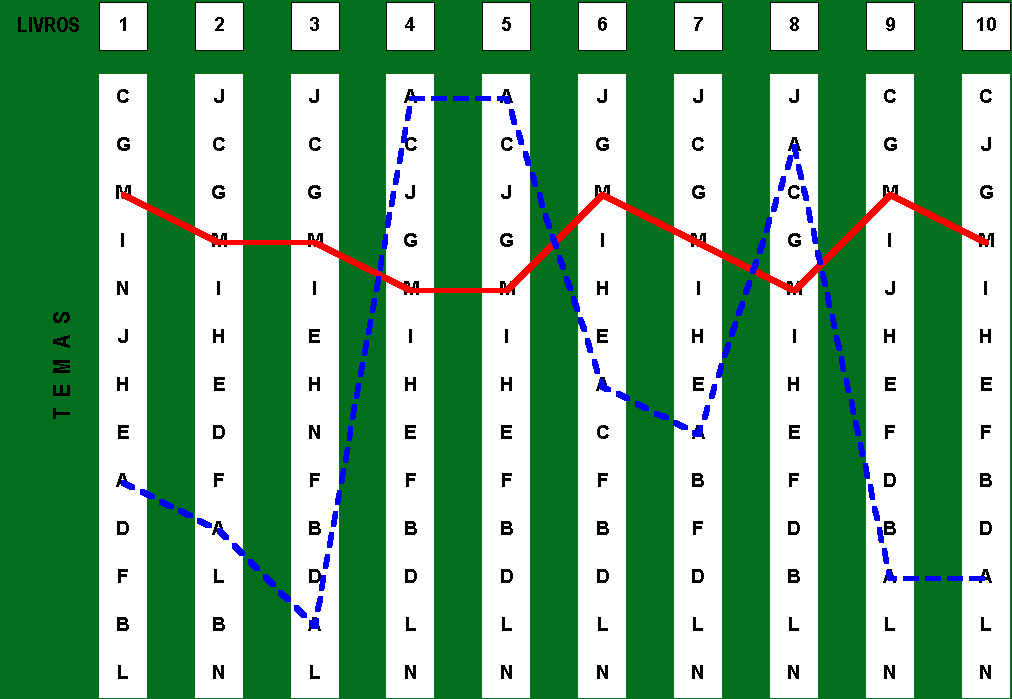
Figura 2: “Matriz de Precedências” indicando o relacionamento entre
os temas: Leis ponderais (A) e Periodicidade química (M)
Os autores analisados divergem quanto à precedência dos temas Leis Ponderais e Periodicidade Química. Verifica-se que apenas 3 em 10 (30%) implementam uma precedência histórica relativamente a esses conteúdos, são eles: Vera Novais (1996); Usberco & Salvador (1997); Tito & Canto (1998).
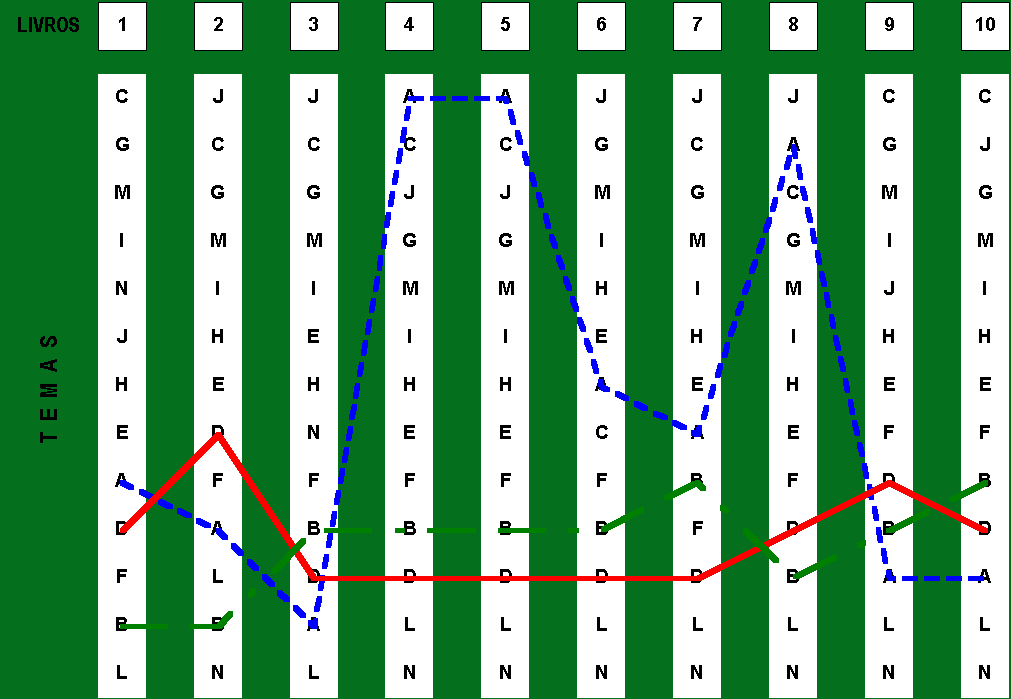
Figura 2: “Matriz de Precedências” indicando o relacionamento
entre os temas: Leis ponderais (A) e Periodicidade química (M)
Na figura 3, estabelece-se novo recorte no sentido de observar-se perspectivas históricas. Os temas analisados são: leis ponderais, estudos dos gases e fórmulas químicas. Indica-se certa regularidade entre os conteúdos de estudo dos gases e fórmulas químicas mas nenhuma aproximação com o perfil observado para as Leis Ponderais.
Na observação da relação entre esses três temas e assumindo-se como precedência histórica [ Estudo dos Gases (B); Leis Ponderais (A); Fórmulas Químicas (D) ], pode-se depreender que nenhum autor utiliza relações de precedência histórica como orientação para a seqüenciação desses conteúdos em sua obra.
Ainda em relação a esse aspecto, vale a pena ressaltar que quando se estipula tal precedência histórica [ B: A: D ] não se pretende indicar que haja um esgotamento do assunto como marco dessa precedência. O estudo dos gases é, por exemplo, bastante ampliado no campo da termodinâmica do século XIX, mas não é nesses termos que pretende ser apropriado pelo Ensino Médio de Química. O prejuízo histórico relativo ao estudo dos gases estaria na obrigatoriedade didática de conduzir o assunto a uma explicitação de fórmulas altamente capazes de resolver problemas algorítmicos, em detrimento de evidenciar como os princípios, hipóteses, axiomas e leis que constituem a base desse estudo conduziram a tais expressões solucionadoras.
A fim de demonstrar-se a diversidade de formas de
organização para esses três temas, observa-se que existem
seis possibilidades de combinação para sua seqüenciação
no currículo. A única forma não contemplada pelos
autores é a que considera-se aqui histórica, como pode ser
observado na tabela a seguir.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2 – Valência nos livros didáticos
Ao analisar os livros didáticos, verificou-se que cinco deles ¾ 50% ¾não fazem nenhuma referência ao conceito de valência. São eles: Juan Ferre (2000); Utimura & Linguanoto (1998); Vera Novais (1996); Usberco & Salvador (1997); Tito & Canto (1998).
Vera Novais (p. 60), Usberco & Salvador (p. 71) e Tito & Canto (p.174) descrevem a camada de valência como sendo a última ou a mais distante do núcleo. Usberco & Salvador implementam essa definição quando tratam da distribuição dos elétrons por subnível, dentro do capítulo de atomística. Vera Novais e Tito & Canto conceituam a camada de valência antes de desenvolver o contexto referente à ligação iônica. Vera Novais utiliza a noção de carbono tetravalente ¾ como aquele que efetua quatro ligações (p.282) ¾ na parte de Química Orgânica, sem imprimir um conceito de valência.
Os outros cinco autores trabalham o conceito de valência com diferente profundidade, para confirmação, são eles: Geraldo Camargo de Carvalho (1997); Hartwig, Souza & Mota (1999); Ricardo Feltre (1996); Marta Reis (1992); Antônio Sardella (1998).
Sem nenhuma dúvida Geraldo Camargo de Carvalho é o autor que, de longe, mais referencia e utiliza o conceito de valência. Sua obra apresenta no início de cada capítulo um texto de cunho histórico/filosófico. No início do capítulo de ligações (p.61), consta um texto que apresenta historicamente aspectos sobre a noção de valência. O trecho é uma tradução de Holton (1976). O texto destaca a importância do conceito de valência como sendo hoje "indispensável para a descrição e compreensão dos fenômenos químicos" (p. 62
Geraldo Camargo de Carvalho inicia o capítulo de ligações químicas com a noção do octeto, partindo para ligação iônica. Coloca um subitem inteiro dedicado à valência, ao final do capítulo. O autor escreve fórmulas de substâncias iônicas e utiliza as proporções entre as quantidades de elementos nelas para concluir sobre a capacidade de combinação dos elementos. A valência é então definida como: "Valência é o poder de combinação ou a capacidade de combinação dos elementos." (Carvalho, p. 77).
Na mesma página que explicita o conceito acima, o autor indica que fora Berzelius quem, em 1820, haveria chamado de valência a capacidade de combinação dos átomos dos elementos. O conhecimento, através de métodos "experimentais" das "fórmulas" de muitos compostos "até essa data" haveria permitido que se pudesse "evidenciar" (p.77) a diferenciação quanto ao poder de combinação dos elementos. A controvérsia imposta ao conceito de valência pelos contra-exemplos só poderia, segundo o autor, ter sido resolvida com o esclarecimento da estrutura atômica, no século XX. O "poder" de combinação, ou seja, a valência dos elementos é função do número de elétrons na última camada ¾ a camada de valência. A valência também é apresentada como sendo a "própria carga dos íons" (p.78). As palavras mono, di, tri ou tetravalente aqui, encerram o módulo de uma carga. A eletrovalência de um elemento é indicada como sendo a valência do elemento "na forma iônica" (ibidem).
O capítulo de Ligações Químicas do livro de Ricardo Feltre se inicia de forma bastante diferente. O parágrafo inicial convida o aluno a uma reflexão sobre a diversidade de materiais e espécies vivas e inanimadas. Diversidade essa que estaria associada às diferentes possibilidades de união dos "cerca de 90 tipos de átomos" (p. 65), que de forma semelhante "à união das letras" podem "formar milhares de palavras com significados diferentes". O surgimento do conceito de valência, na metade do século XIX, é relacionado à verificação das diferentes possibilidades de "ligação" que elementos como oxigênio, nitrogênio e carbono estabelecem com o hidrogênio, em suas palavras: "..., por exemplo, o átomo de oxigênio pode ligar-se a dois átomos de hidrogênio" (p.66). Ricardo Feltre apresenta fórmulas estruturais planas para consubstanciar sua asserção histórica. A idéia de valência "surgiu, então" (IBIDEM) como o autor apresenta: "...capacidade de um átomo ligar-se a outros" (Feltre, p. 66). As propriedades mono, di, tri e tetravalente são associadas aos elementos hidrogênio, oxigênio, nitrogênio e carbono. O autor não apresenta nenhum contra-exemplo para o modelo e indica que somente no século XX chegou-se a uma "explicação lógica" para as uniões entre os átomos, qual seja a "Teoria Eletrônica da Valência". Que seria, então, uma "criação" de Lewis e Kossel.
Também incluído no capítulo de Ligações Químicas ocorre o conceito de valência na obra de Hartwig, Souza & Mota. Os autores utilizam a capacidade de combinação de substâncias iônicas, constituída a partir da regra do octeto, para indicar que podem ser representadas por números, esse números receberiam o nome de valência, a saber: "Valência é o número que indica a capacidade máxima de combinação de um elemento" (Hartwig, Souza & Mota, p. 142). O termo eletrovalên-cia seria o análogo de valência para "o caso dos íons" (p.143), ou seja, um número, cujo valor agora é semelhante ao "valor da carga elétrica do íon". Como seqüência, define-se o termo "camada de valência". Os autores colocam que a "capacidade de combinação" depende da camada de valência. Observe-se que aqui a valência não é a capacidade de combinação, dado que é o número que indica o valor máximo desta capacidade. Não há como elucidar o que é esta "capacidade de combinação" apenas entende-se que "isso" depende da quantidade de elétrons no último nível eletrônico do elemento em questão.
A professora Martha Reis Marques da Fonseca intitula o capítulo que discute os diferentes aspectos das Ligações Químicas de "Teoria Eletrônica de Valência". A possibilidade de entender-se o que seria essa intitulada "Valência" só é permitida após todo o discurso do octeto, das ligações iônicas, ligações covalentes e inclusive geometria molecular. A valência é apresentada pela autora conforme a seguir: "Chamamos de valência de um elemento o número de ligações, iônicas ou covalentes, que um átomo desse elemento é capaz de estabelecer." (Fonseca, p.131). A valência é também um número, que agora indica a quantidade de ligações que um elemento pode fazer. Nesse caso, entende-se que a valência é um atributo do esquema conceitual de ligações químicas. Entender ou prever a valência depende de entender e prever as ligações possíveis de um elemento.
Antônio Sardella divide a apresentação das Ligações Químicas em duas partes. Na primeira parte ocorre o conceito de valência, articulado com a quantidade de elétrons no último nível que os elementos possuem. As combinações são função da diferente quantidade de elétrons de valência, havendo necessidade, então, de identificar o que seja a valência."Valência é a capacidade de combinação dos átomos" (Sardella, p. 32). Na obra de Sardella, o conceito de valência ocorre dentro do item eletrovalência, a valência em si possui parco sentido, sendo privilegiadas as suas conseqüências. Por exemplo, "quando as valências resultam em cargas elétricas, originando íons, chamamos de eletrovalência, e a ligação em questão é denominada eletrovalente ou iônica" (ibidem).
Observa-se que o conceito de valência, quando
definido nos livros didáticos analisados, carrega os seguintes termos,
que procuram caracterizar seu significado, conforme os autores:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pode-se organizar a noção de valência,
dessa forma, como associada a duas "categorias ontológicas"[2].
Entende-se que as descrições relativas a poder e capacidade,
conforme descrita pelos autores em suas respectivas obras podem ser circunscritas
a uma única, que aqui será tomada somente pela palavra poder,
por compreender-se que esta é mais expressiva da noção
que quer descrever. Assim tem-se:
|
|
|
|
|
|
Ainda no contexto da ontologia da valência, outras fontes de divulgação revelam proximidade com a categorização apresentada anteriormente. A Enciclopédia Britannica (1999) expressa a valência como, "segundo o conceito clássico, a capacidade de combinação do átomo de um elemento químico" (v. 14, p. 290). No outro sentido de categorização, o "Dictionaire de la Chimie et des ses Applications" (1978) apresenta a valência como "uma noção muito delicada que procura precisar o número possível de átomos de uma dada natureza que podem se ligar quimicamente a um determinado átomo" (p. 1049). Tem-se, mesmo em fontes distintas de livros didáticos, uma leitura ontológica da valência relacionando-se a "poder" e a "número".
Outro aspecto de análise atraente se dá, no momento em que se organiza, para cada autor, a argumentação utilizada para elaborar a apresentação do conceito de valência.
Afim de manter-se a ênfase na apresentação dos resultados em função de aspectos que possam revelar as proximidades dos autores com as noções históricas do conceito, procura-se classificar a argumentação em duas "naturezas" distintas, a saber:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Para finalização desse conjunto de análises, deve-se enfatizar que em todos os livros analisados que apresentavam a noção de valência, esse conceito estava inserido no capítulo de Ligações Químicas. Diferiam, no entanto, quanto à precedência, no interior do capítulo. Para todos os autores as noções de eletrovalência são apresentadas antes das noções de covalência. Em apenas um caso (FELTRE), ocorre uma conceituação do que é valência antes dos outros sub-temas. Apresenta-se a seguir a forma de organização utilizada pelos autores em relação a eletrovalência (E), covalência (C) e valência (V).
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.3 – Alguns aspectos históricos sobre a noção clássica de valência
Apresenta-se a seguir um resumo dos aspectos históricos que nortearam a avaliação realizada nos livros didáticos. Tais aspectos constituem, principalmente, elementos que visam subsidiar nossas conclusões.
A noção clássica de valência constitui-se como herdeira da afinidade química. A affinitas de Alberto Magno (séc. XIII) é recolocada por Etiéne Geoffroy em 1718 e consagrada por Torbern Bergman em 1788 no Tratado de Afinidades Químicas ou Atrações Eletivas. Lavoisier foi um crítico das afinidades e procura na teoria do calórico a justificativa mais ampla para os processos de transformação. Quando a lei das proporções definidas se torna um fato para os químicos, a afinidade, conforme derivada da filosofia mecanicista devia explicar ao mesmo tempo as formas de combinação de um composto químico e a sua reação.
O poder da eletroquímica como técnica de análise consagra-se por volta de 1800 com uma teoria eletroquímica das combinações, a Teoria Dualista de Jacob Berzelius. Existe um crescimento intensivo da quantidade de corpos simples, promovido pela utilização da eletrólise como método analítico.
Duas tendências podem ser destacadas a partir de manuais de Química do século XIX: Uma Química analítica positivista que se entrega ao estudo particular dos corpos; e uma disposição para a formulação de idéias sobre a transformação dos materiais, e sobre a forma de constituição dos corpos. O problema da valência está inserido neste segundo grupo.
Na tentativa de dar conta das formas de combinação dos elementos, são formulados alguns modelos explicativos: Teoria dos Radicais (por Jean Baptiste Dumas & Pierre Boullay em 1828); Teoria das Substituições (por Dumas em 1834); Teoria dos Núcleos (por Auguste Laurent em 1836); Teoria dos Resíduos (por Charles Gerhardt em 1839); Teoria dos Tipos (por Charles Gerhardt em 1842); Teoria da Força de Combinação (por Edward Frankland em 1847). Dentre esses modelos, considera-se como o mais influente para a estruturação da noção clássica de valência, a Teoria dos Tipos.
Os artigos entre 1850 e 1860 consideravam a valência como uma propriedade de um elemento particular, que juntamente com o peso atômico, fazia um elemento diferente de outros. Friedrich Kekulé (1867) é o primeiro a utilizar o termo valência como forma de caracterizar as diferentes potencialidades de combinação dos elementos.
Pode-se considerar que a noção de valência, conforme historicamente estabelecida, representou um dos mais férteis campos para o debate sobre o que se pode considerar um dos "objetos últimos" da Química, a saber: quais as causas das transformações da matéria, suas características, condições e variações. A controvérsia a respeito da noção clássica de valência, se apresenta valiosamente fecunda. Seu estabelecimento como programa de pesquisa guarda íntima relação com o não menos interessante conceito de afinidade. A noção clássica de valência guarda maior relação com a afinidade, conforme estabelecida antes do "paradigma Newtoniano". Para os seguidores da Química Newtoniana, as causas do fenômeno químico localizam-se na exterioridade do "corpus". A Química do século XIX, que conduz à noção clássica de valência, procura constituir uma causa no interior desse "corpus". Ou seja, os atributos da modificação desse objeto estão no interior dele, a ele pertencem e, mais ainda, são caracterizadores de sua existência.
A Teoria dos Tipos que se desenvolve no interior da Química Orgânica a partir de meados do século XIX, tem a intenção de formular uma classificação que já internaliza uma característica dual, que será herdada pela noção de valência. Os tipos identificam e agrupam espécies que possuem a mesma "natureza" e que encerram números como descritores de suas propriedades ¾ e.g. díade / dibásico / diatômico / divalente. Não há clareza em termos da determinação de qual nomenclatura deve ser aceita, ¾ valência, equivalência, quantivalência ¾ mas existe uniformidade quanto ao reconhecimento da necessidade de identificar-se numericamente as possibilidades de combinação das espécies em estudo. Somente estudos mais apurados em referências primárias poderia aclarar como se relacionam as categorias poder e número, no contexto da ontologia da valência. Mas pode-se tomar como seguro que existe uma herança de valência como poder, a partir da noção de afinidade; e outra de valência como número, herdada da Teoria dos Tipos. O problema da primazia sobre a noção de valência é também bastante interessante. Não há consenso entre os historiadores.
A noção de valência está intimamente relacionada com os primeiros passos da Química Orgânica. Pode-se dizer que a valência orientou e foi orientada pelos "programas de pesquisa orgânicos", muito antes de ser reconduzida à Química Inorgânica. Num mundo ainda sem elétrons, a valência é a causa da ligação química. Essa ligação, por sua vez, é formulada sem interesse em dar conta de suas causas. A ligação química, posteriormente à valência irá ser estabelecida como um atributo externo ao corpo químico.
4 - Conclusões
Como uma noção que pode ser apropriada didaticamente, a valência possui, para diferentes autores de livros, as mesmas "categorias ontológicas" que historicamente foram constituídas: poder e número. Essa particular simetria entre a História da Química e Ensino de Química pode indicar que, em alguma medida, possam existir condicionantes históricos como critérios para a seleção dos temas do currículo. Ao mesmo tempo, essas possibilidades são reduzidas tanto por uma apropriação mais precisa do próprio sentido histórico que o conceito carrega, observando-se que são eliminadas as controvérsias e a noção de valência simplesmente "surge"; quanto pela organização do material didático, que elimina as condições de precedência histórica ao formalizar os elementos de uma Teoria Eletrônica da Valência, sem antes se indicar o que é a valência.
A organização dos temas nos livros didáticos de Química não é casual. Existem conjuntos que apresentam rigorosas regularidades quanto à ordem e seqüenciação, mesmo para diferentes autores, enquanto outros são tomados como possuindo "graus de mobilidade" de diferentes níveis. As relações históricas de precedência são formalmente excluídas, talvez não pela intenção, mas sim por que são sufocadas pelos "imperativos didáticos" que conduzem a forma utilizada pelos autores nessa empreitada a se constituir num conjunto de esquemas ¾ nem ao menos heurísticos ¾ , que mais propriamente se destinam à solução de problemas algorítmicos.
Deve-se ampliar a leitura de quais temas são "fixos" na organização do currículo e que tipo de mobilidade os outros possuem. Essa leitura, a partir da História da Química, precisa ser iluminada pela História da disciplina Química. Essa parceria configura que a transposição didática é um domínio que também deve ser abraçado para atingir-se esse fim. Os livros didáticos de Ensino Superior e Fundamental devem também ser observados. Os de ensino superior influenciam os de ensino médio, uma vez que os livros universitários devam estar mais próximos do que a ciência considera atual, ou do que seja mais interessante de ser ensinado aos neófitos. Os de ensino médio também estão envolvidos de alguma maneira nesse círculo didático de influências. O último ano do ensino fundamental costuma abraçar temas de Química. Para este ano podem ser encontrados livros com capítulos exclusivos para os assuntos relacionados a Química. Essa necessidade de observação mais abrangente presume também que o Ensino Médio não é necessariamente um fim, nem se estabelece como um segmento isolado ou independente no contexto da educação mais ampla.
Bibliografia
APPLE, Michael W. Trabalho docente e textos. Porto Alegre: Artes
Médicas, 1995. 218 p.
CARVALHO, Geraldo Camargo de. Química Moderna. 2 ed. São Paulo: Scipione, 1997. 469p.
COULSON, C. A. Valence. 2 ed. Londres:Oxford University Press, 1961. 404 p.
DUVAL, C., DUVAL, R. Dictionaire de la chimie et de ses applications. 3 ed. Paris: Technique et Documentation, 1978.
FELTRE, Ricardo. Química. 4 ed. São Paulo: Moderna, 1994, 467p.
FERRÉ, Juan, Química. 3 ed. São Paulo: Scipione, 2000.
FONSECA, Martha Reis M. Química. v. 1. São Paulo: FTD, 1992.
FORQUIN, Jean-Claude. Saberes escolares, imperativos didáticos e dinâmicas sociais. Teoria & Educação, n. 5, p. 28-49, 1992.
GOODSON, Ivor. Currículo: teoria e história. Petrópolis: Vozes, 1995.
HARTWIG, Dácio; SOUZA, Edson; MOTA, Ronaldo. Química. São Paulo: Scipione, 1999, 415p.
JAPIASSÚ, Hilton. Um desafio à educação: repensar a pedagogia científica. São Paulo:Letras & Letras, 1999, 267 p.
KUZNETSOV, V. I. (org.) Theory of valency in progress. Moscou: Mir Publishers, 1980. 262 p.
LIN, H. S. The effectiveness of teaching chemistry through the history of science. Journal of Chemical Education, v. 75, n. 10, p. 1326-1330, 1998.
LOPES, Alice R. C. Livros didáticos: obstáculos ao aprendizado da ciência química. Dissertação (Mestrado em Educação), Fundação Getúlio Vargas, 1990.
MATTHEWS, Michael. História, Filosofia e Ensino de Ciências: a Tendência Atual de Reaproximação, Cadernos. Cat. de Ensino de Física. v. 12, n. 3, p. 164 – 214, 1995.
MOREIRA, Antonio Flávio. (org) Currículo: questões atuais. Campinas: Papirus, 1997, 143p.
MORTIMER, Eduardo F. A evolução dos livros didáticos de química destinados ao ensino secundário. Em Aberto, n. 40, out/dez, 1988.
NIAZ, M. A rational reconstruction of the kinetic molecular theory of gases based on history and philosophy of science and its implications for chemistry textbooks. Instructional Science, v. 28, p. 23-50, 2000.
NOVAIS, Vera. Lúcia D. Química. São Paulo: Atual, 1996. 501 p.
PERUZO, Francisco; CANTO, Eduardo. Química na abordagem do cotidiano. 2. ed. São Paulo: Moderna, 1998, 479p.
PIAGET, Jean. & GARCIA, Rolando. Psicogênese e história das ciências. Lisboa: Publicações Dom Quixote, 1987. 251 p.
RUSSELL, Colin A. History of Valency. Chicago: University of Chicago Press, 1972.
SANTOMÉ, Jurjo Torres. Globalização e interdisciplinaridade: o currículo integrado. Porto Alegre: Artes Médicas, 1998, 275 p.
SARDELLA, Antônio. Química. 3 ed. São Paulo: Ática, 1998.
SAVIANI, Demerval. LDB: A nova lei da educação: trajetória, limites e perspectivas. São Paulo: Autores Associados, 1997, 242p.
SCHNETZLER, Roseli P. O tratamento do conhecimento químico em livros didáticos brasileiros para o ensino secundário de química de 1875 a 1978. Dissertação (Mestrado em Educação), Universidade Estadual de Campinas, 1980.
SOARES, Magda Becker. Um olhar sobre o livro didático. Presença Pedagógica, v. 2, n. 12, p. 53-62, 1996.
USBERCO, João & SALVADOR, Edgard. Química. São Paulo: Saraiva, 1997. 605 p.
UTIMURA, Teruko Y. & LINGUANOTO, Maria. Química. 1 ed. São Paulo: FTD, 1988.
WORTMANN, Maria Lúcia Castagna. É possível articular a epistemologia, a história da ciência e a didática no ensino científico?. Epistéme, Porto Alegre, v.1, n.1, p. 59-72, 1996.
[1] Por exemplo, o que é descrito
como periodicidade química em uma obra aparece como tabela periódica
em outro.
[2] A Ontologia é o campo,
dentro da filosofia, que se relaciona ao entendimento da “natureza da existência”,
da “natureza do ser”. As questões: “o que é a existência?”,
“que tipo de entidades existem?” são os tópicos principais
da Ontologia Uma categoria ontológica refere-se ao conceito de entidade.
As “coisas” que existem são chamadas de entidades (do grego “ontos”).
Uma categoria ontológica deve fornecer as idéias fundamentais
para a conceituação/demarcação de uma entidade.
As entidades existentes podem ser chamadas de “Estruturas Concretas”. As
entidades possuem atributos fundamentais: i) nenhuma entidade pode existir
isolada de outras entidades; ii) as entidades possuem estruturas internas
que as diferenciam umas das outras.