O
aparente paradoxo do ar quente
Ar quente
sobe, certo? Logo é quente nas montanhas e frio
no litoral...
Que
o ar quando é aquecido se expande, todo mundo sabe. Que ao se expandir
ele se torna menos denso, também todo mundo sabe. Que ao se tornar menos
denso ele sobe, por causa do empuxo do ar externo, novamente todo mundo sabe:
assim que são feitos os balões. Logo, é mais quente nas
montanhas – para onde vai o ar aquecido – do que no litoral?
Em situações normais o litoral
é mais quente do que as montanhas. E isso, também, todo mundo
sabe. Parece, então, que está faltando alguma
informação para colocar as coisas em seus devidos lugares, o ar
quente nas praias e o ar frio nas montanhas.
Para entender completamente o que acontece,
precisaríamos estudar os complexos processos físicos na
atmosfera. Entretanto, podemos entender porque é frio nas montanhas e
quente no litoral, apesar do ar quente tender a subir, sem precisar grandes
estudos de meteorologia. Para tanto, primeiramente iremos relembrar alguns
conceitos físicos básicos relacionados à
termodinâmica.
Esfriando e aquecendo um
gás
O leitor já deve ter ouvido falar que a
temperatura está relacionada à energia interna de um gás.
E que esta energia interna, por sua vez, está relacionada à
velocidade média das moléculas, ou seja, a energia
cinética dessas moléculas: quanto mais quente maior é a
energia interna e a velocidade média das moléculas.
Agora,
direcionando nosso estudo para o comportamento dos gases, sabemos que existem
pelo menos duas maneiras de alterar a energia cinética das
moléculas de um gás, ou seja, sua energia interna e,
consequentemente, sua temperatura. A primeira delas, bem trivial e simples de
imaginar um exemplo prático, consiste em aquecer ou esfriar o
gás, colocando-o em um ambiente a uma temperatura diferente. A segunda
forma nos diz que é possível alterar a temperatura de um
gás, deixando-o realizar trabalho contra uma força externa ou que
uma força externa realize trabalho sobre o gás. Imagine que se um
gás faz trabalho contra uma força externa, o sistema sobre o qual
o trabalho é feito ganha energia; logo, como deve haver a
conservação da energia no sistema, o gás perde energia. Se
perder energia, como dissemos acima, ele esfria. Apesar da
descrição mais detalhada da segunda forma de alterar a energia
interna das moléculas do nosso gás, o leitor talvez possa
não estar encontrando um exemplo do cotidiano, mas é simples.
Quando enchemos um pneu de bicicleta, pressionamos o ar dentro da bomba,
fazendo trabalho sobre ele. Nós perdemos energia (fazendo trabalho sobre
a bomba) ao fazer isso, e o gás dentro da bomba ganha energia e se aquece(i). Podemos perceber
isso verificando o quão quente fica a bomba após algumas
pressionadas. Este é um exemplo mais ou menos trivial de que quando se
faz trabalho sobre um sistema ele se aquece.
O contrário também
é verdade. Quando um gás a certa temperatura se expande contra um
agente que faça uma força sobre ele, ele se esfria. Por exemplo,
quando gás pressurizado em um compartimento, como os de desodorantes do
tipo spray, sai desse compartimento, ele faz um trabalho contra o ar
atmosférico, se esfriando. Com um pouco de atenção,
podemos perceber isso brincando com um tubo de desodorante.
Resumindo: se um gás se
expande contra uma força externa, ele se esfria; se é comprimido
por uma força externa, se aquece.
Expansão e
resfriamento
Quando o gás que
está pressurizado em um tubo de desodorante (do tipo spray) sai, ele
encontra-se inicialmente sob pressão mais alta que a atmosfera. Com
isso, se expande, até atingir a pressão atmosférica. Ao se
expandir, o gás faz um trabalho contra uma força externa que o
comprime, a força feita pelo restante do ar atmosférico. Ao fazer
trabalho, sua energia interna diminui e, com isso, sua temperatura
também diminui.
O mesmo efeito ocorre com uma
massa de ar que é empurrada de uma região com maior
pressão para uma região com menor pressão, por exemplo, ao
subir uma montanha. Nesse processo o ar se expande e se esfria. O nome
técnico que esse processo recebe é “expansão
adiabática”, ou seja, expansão sem troca de energia
térmica com o ambiente.
Conclusão: essa é a razão pela
qual o ar é frio no alto das montanhas e quente no litoral.
Na
verdade, não precisa haver montanhas para o ar subir e se esfriar. Em
altitudes até cerca de dez quilômetros há sempre movimentos
horizontais e verticais do ar, o que faz com que a temperatura decresça
com a altitude mesmo que não haja montanhas por perto.
Fazendo as contas
Para
fazer as contas de quanto o ar esfria-se, você precisa de duas
equações. A equação de estado para um gás
ideal é
![]() ,
,
onde P
é a pressão (em N/m2 no sistema internacional),
V é o volume (m3 no SI), n é o
número de moles daquela amostra de gás, T é a
temperatura em K e R = 8,3J/mol.K.
Essa equação vale sempre, desde que o gás não
esteja muito comprimido. Por exemplo, a uma atmosfera (P = 1,01.105N/m2),
a
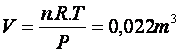 ,
,
ou seja, 22litros.
A outra equação necessária
é a que diz o que ocorre com um gás que não troca energia
com algum outro sistema por causa de uma diferença de temperatura, ou
seja, em linguagem técnica, sofre uma transformação
adiabática. Essa equação é
![]() ,
,
onde Po, Vo,
P1 e V1 são valores de
pressão e volume ocupados pelo gás em duas
situações diferentes. O expoente γ depende do tipo de gás e, no caso do ar, quase
totalmente formado de N2 e O2 (gases diatômicos)
vale 1,4(ii). Por exemplo, considere uma
amostra de gás a 1 atm
que ocupa um volume de
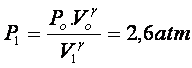 .
.
Para
descobrir a nova temperatura (T1) do gás após a expansão,
basta usar a equação de estado (1):
![]()
![]()
Agora imaginemos, uma situação
aplicada a atmosfera e seus movimentos. Para tanto,
observe a figura abaixo:
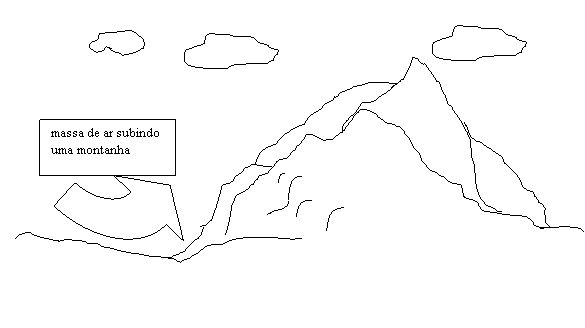
A figura nos mostra uma dada massa de ar subindo a
montanha, pense que este fato pode ser devido, por exemplo, a um vento
ascendente. Como o nosso propósito com o texto era de entender um pouco
sobre a dinâmica atmosférica de uma forma simples, é justo
propor um cálculo para uma massa de ar qualquer. E para isso
necessitaremos de apenas uma equação além das apresentadas
anteriormente ((1) e (2)). A nova equação relaciona o decréscimo
da pressão com a variação de altitude h a partir de um referencial localizado ao nível do mar. Sua
dedução não vem ao caso neste nosso texto. A equação
é:
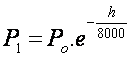 ou
ou  ,
,
onde e é o número de Euler (e = 2,718).
Assim, para uma montanha de por exemplo
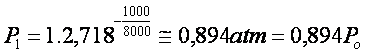
E agora, levando em consideração que
a equação (2) pode ser escrita da seguinte maneira:
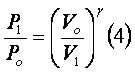 , podemos
igualar (3) e (4) e achar uma relação
semelhante para a variação de volume devido a ascenção
da massa de ar
, podemos
igualar (3) e (4) e achar uma relação
semelhante para a variação de volume devido a ascenção
da massa de ar
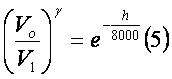 .
.
Substituindo os valores, temos:
 Assim, obtemos:
Assim, obtemos: ![]() .
.
E finalmente, aplicando os novos valores de
pressão e temperatura podemos, usando a equação de estado
(1), para uma temperatura inicial de 300 K
qualquer, obteremos uma nova temperatura T1 = 292 K (aprox.).
Agora vc já será capaz de fazer o cálculo
para massas de ar. Agora, faça uma conta para a diferença de
temperatuda que o litoral tem quando comparado a cidade de São Paulo por
exemplo, compare seus cálculos com as médias de temperatudas das
duas regiões, tente!
(i) Você poderia então pensar
que se o ar na bomba se aquece, então a pessoa que bombeia o ar se
esfriaria! Sabemos que é exatamente o contrário: a pessoa
também se aquece e se continuar bombeando pode começar a suar, de
tanto que se aqueceu. Mas falta um ingrediente: para fazer trabalho bombeando o
ar a pessoa precisa produzir mais energia do que a que está transferindo
para o ar da bomba, “queimando comida” dentro de seu corpo. Como a
eficiência do corpo humano é da ordem de 20% ou 30%, nosso organismo
produz bem mais energia do que a que está sendo transferida para o ar e,
assim, se aquece.
(ii) Para o eventual cálculo de uma
transformação adiabática com um gás
monoatômico use γ =
1,7.